人类蛋白质组约包含2万个蛋白质,目前认为有近4000个蛋白与疾病相关。但已有上市药物的靶蛋白质仅有500多个,大部分疾病相关蛋白有待开发。“不可药”靶标是指那些对于疾病治疗具有重要意义,但传统药物研发方法难以应对的靶标。这类靶标通常缺乏明确的配体结合口袋,或者具有保守的活性位点,难以实现靶向特异性。近年来计算模拟和人工智能方法的发展正在改变药物设计的格局,为克服这些挑战提供创新策略。
伊人直播-伊人直播ios 、定量生物学中心、北大-清华生命科学联合中心和伊人直播 成都前沿生物技术研究院的来鲁华教授课题组长期致力于发展基于物理模型和人工智能的小分子、多肽和蛋白质药物设计方法,针对不同类型的“不可药”靶标提出了用于靶向无序蛋白的小分子配体“多构象亲和”策略、用于预测蛋白质别构位点的基于结构、动力学和进化信息的方法以及用于从头设计靶向蛋白-蛋白相互作用界面的环肽抑制剂设计方法等,在多个重大疾病相关靶标上经过设计与实验获得了可成药性分子并进行了转化。
近期,他们受邀在《Chemical Reviews》的“Drugging the Undruggable”特刊上发表了题为“Computer-Aided Drug Discovery for Undruggable Targets”的综述。系统性总结了基于物理模型和人工智能的计算方法在针对“不可药”靶标的小分子药物设计领域的最新进展,分析了相关成功案例,指出了目前所面临的挑战,并展望了未来的发展方向。
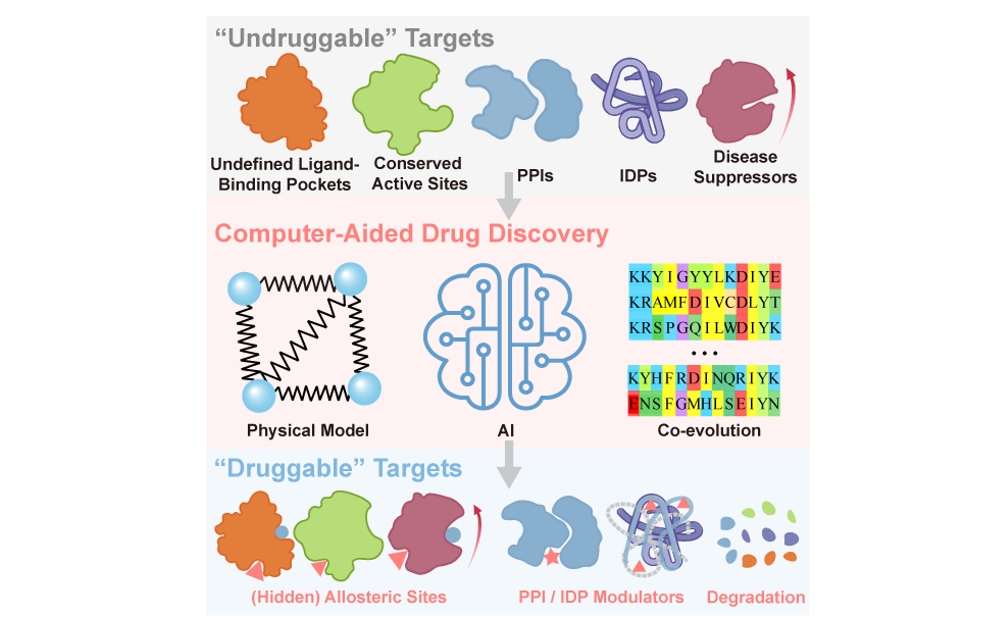
图1.计算药物设计方法正在重塑“不可药”靶标的定义
根据靶标难以被调控的原因,该论文将“不可药”靶标分为五类:(1)缺乏合适的小分子配体结合口袋的蛋白,(2)活性位点保守的蛋白,(3)天然无序蛋白,(4)蛋白-蛋白相互作用或大组装体界面,(5)需要被激活的疾病抑制蛋白。重点针对靶向无序蛋白、靶向别构位点、靶向蛋白-蛋白相互作用和靶向蛋白降解进行了系统总结,探讨了相关策略的最新进展、成功案例及其面临的挑战,为未来的药物研发提供了重要见解。作者深入探讨了计算方法与人工智能技术对于不可药靶标药物研发领域的推动,特别是在药物靶标识别、蛋白质动态结构预测与别构位点发现、虚拟筛选效率提升以及分子生成等核心环节的关键作用。并指出药物发现策略的持续优化正在重塑"不可药"靶标的定义——从最初的"难以药物化"逐步演变为"有待药物化",这一概念上的突破极大地拓宽了可成药靶标的范围。
作者在展望中指出,尽管靶向无序蛋白、蛋白-蛋白相互作用、别构调控以及蛋白降解等领域已取得了显著进展,但这些研究方向仍存在重大挑战。例如,无序蛋白配体的优化存在很大困难,而隐藏别构位点的发现也面临挑战。随着新药物靶标的不断发现及其结构与功能研究的深入,潜在的治疗靶标空间正在不断扩大,RNA等非蛋白质靶标的小分子配体发现愈发受到关注。因此,构建靶标特异性的化合物库,探索更大的化学空间,发展基于AI的药物生成模型,并发展高通量实验方法结合计算预测来探索可合成的类药分子空间是值得关注的方向。另一方面,与靶标结合的蛋白质及多肽设计也为不可药靶标的可药性提供了新的可能。在不久的将来,这些创新的发展策略有可能将大多数“不可药”靶标转变为可药靶标,为相关疾病带来新的治疗机会。
来鲁华教授和孙琦副研究员为该论文的通讯作者,博士生王瀚平、博士后谢娟、博士生王丽莹、穆俊羲、李隽仁和任宇浩为该工作做出了重要贡献。来鲁华课题组的相关工作得到了国家自然科学基金委、科技部、中国医学科伊人直播 创新单元、四川省科技计划、中国博士后基金、北京分子科学国家研究中心和北大-清华生命科学联合中心等项目的支持。
原文链接://pubs.acs.org/doi/10.1021/acs.chemrev.4c00969
审核:李玲 刘志博