еЃЮй™МеЃ§жЦ∞йЧ?/h4>
зОЛеИЭиѓЊйҐШзїДеПСе±Хз°ЂиЊЫйЕ∞еМЦдњЃй•∞зЪДзїДе≠¶йЙіеЃЪжЦ∞жЦєж≥?/h1>
дљЬиАЕпЉЪ
жЭ•жЇРпЉ?nbsp;
еПСеЄГжЧ•жЬЯ:2022-06-04
ињСжЧ•пЉМеМЧдЇђе§Іе≠¶еМЦе≠¶дЄОеИЖе≠РеЈ•з®Ле≠¶йЩҐгАБеМЧе§?/span>-жЄЕеНОзФЯеСљиБФеРИдЄ≠ењГзОЛеИЭиѓЊйҐШзїДеЬ®Journal of American Chemical SocietyжЭВењЧдЄКеПСи°®йҐШдЄЇвА?/span>Quantitative Site-Specific Chemoproteomic Profiling of Protein LipoylationвАЭзЪДз†Фз©ґжЦЗзЂ†гАВеЬ®ињЩй°єеЈ•дљЬдЄ≠пЉМдљЬиАЕеПСе±ХдЇЖжЦ∞еЮЛзЪДзФ®дЇОжНХиОЈз°ЂиЊЫйЕ∞еМЦдњЃй•∞зЪДеМЦе≠¶жОҐйТИпЉМеєґзїУеРИеЃЪйЗПеМЦе≠¶иЫЛзЩљиі®зїДе≠¶зЪДжКАжЬѓпЉМй¶Цжђ°еЃЮзО∞еЬ®е§ІиВ†жЭЖиПМеТМеУЇдє≥еК®зЙ©зїЖиГЮдЄ≠зЪДз°ЂиЊЫйЕ∞еМЦдњЃй•∞дљНзВєеЕ®е±АжАІйЙіеЃЪдЄОеЃЪйЗПпЉМеєґеѓєе§ІиВ†жЭЖиПМдЄ≠зЙєеЃЪеЇХзЙ©иЫЛзЩљдЄ≠дЄЙдЄ™з°ЂиЊЫйЕ∞еМЦдњЃй•∞дљНзВєзЪДи∞ГжОІеТМз°ЂиЊЫйЕ∞еМЦдњЃй•∞еРИжИРйЕґзЪДеКЯиГљињЫи°МдЇЖз†Фз©ґгА?/span>
з°ЂиЊЫйЕ∞еМЦдњЃй•∞жШѓдЄАзІНйАЪињЗйЕ∞иГЇйФЃе∞Жз°ЂиЊЫйЕЄеЕ±дїЈињЮжО•еИ∞иЫЛзЩљиі®иµЦж∞®йЕЄжЃЛеЯЇдЄКзЪДзњїиѓСеРОдњЃй•∞гАВз°ЂиЊЫйЕ∞еМЦдњЃй•∞еЬ®ињЫеМЦдЄ≠йЂШеЇ¶дњЭеЃИпЉМеєґдЄФдљНдЇОзїЖиПМеТМеУЇдє≥зїЖиГЮж†ЄењГдї£и∞ҐйАФеЊДеЗ†зІНйЗНи¶БиЫЛзЩљиі®е§НеРИзЙ©зЪДжіїжАІеП£иҐЛдЄ≠пЉМдљЬдЄЇеЕ≥йФЃиЊЕеЫ†е≠РеПСжМ•зЭАйЗНи¶БзЪДеВђеМЦдљЬзФ®гА?/span>з°ЂиЊЫйЕ∞еМЦдњЃй•∞зЪ?/span>姱и∞ГдЄОдЇЇз±їдї£и∞ҐзіКдє±гАБзЩМзЧЗз≠ЙзЦЊзЧЕзЫЄеЕ≥гАВеЫ†ж≠§пЉМеК†жЈ±еѓєз°ЂиЊЫйЕ∞еМЦдњЃй•∞и∞ГиКВзЪДзРЖиІ£еѓєдЇОз†Фз©ґдЄОињЩдЇЫзЦЊзЧЕзЫЄеЕ≥еИЖе≠РжЬЇеИґеЕЈжЬЙйЗНи¶БзЪДжДПдєЙгА?/span>
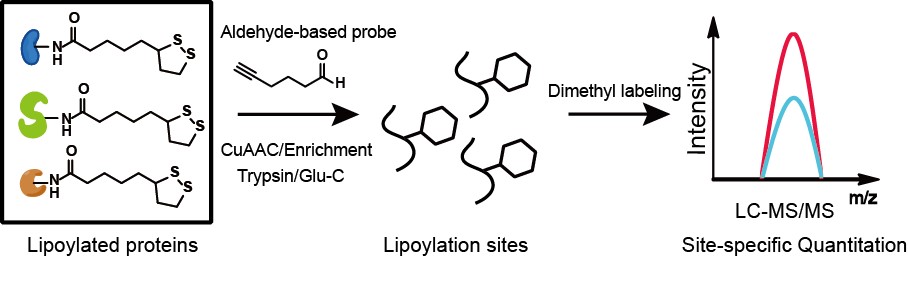
жЬ?/span>еЈ•дљЬеПСе±ХдЇЖдЄАзІНж†ЗиЃ∞з°ЂиЊЫйЕ∞еМЦдњЃй•∞зЪДжОҐйТИеТМдЄАе•ЧеЕЈжЬЙдљНзВєеИЖиЊ®зОЗзЪДеЃЪйЗПеМЦе≠¶иЫЛзЩљиі®зїДжКАжЬѓгА?/span>дљЬиА?/span>еПЧйЖЫеЯЇеЯЇеЫҐдњЭжК§з≠ЦзХ•дЄ≠еЄЄзФ®зЪДеЯЇдЇОз°ЂзЉ©йЖЫзЪДжЦєж≥ХеРѓеПСпЉМиЃЊиЃ°дЇ?/span>дЄБйЖЫжОҐйТИBAPгАВиѓ•жОҐйТИдЄ≠еРЂжЬЙйЖЫеЯ?/span>пЉ?/span>еПѓдЄОз°ЂиЊЫйЕ∞еМЦдњЃй•∞еПСзФЯзЉ©еРИеПНеЇФпЉМеєґзїУеРИзФЯзЙ©ж≠£дЇ§еЯЇеЫҐзВФеЯЇпЉМйАЪињЗйУЬеВђеМЦзЪДзВєеЗїеМЦе≠¶еПНеЇФеЉХеЕ•еПѓеИЗеЙ≤зЪДеѓМйЫЖж†Зз≠ЊгА?/span>дљЬиАЕзїУеРИеЇХзЙ©еЇПеИЧеИЖжЮРзїУжЮЬпЉМдљњзФ®V8иЫЛзЩљеЖЕеИЗйЕ?/span>еПѓдї•еЃЮзО∞дЇ?/span>еѓєе§ІиВ†жЭЖиПМдЄ≠жЙАжЬ?/span>еЈ≤зЯ•з°ЂиЊЫйЕ∞еМЦдњЃй•∞дљНзВєзЪ?/span>йЙіеЃЪгА?/span>
еИ©зФ®еПСе±ХзЪ?/span>е§ІиВ†жЭЖиПМз°ЂиЊЫйЕ∞еМЦдњЃй•∞дљНзВєеЃЪйЗПз≠ЦзХ•пЉ?/span>жЬђеЈ•дљЬеПСзО∞еЇХзЙ©иЫЛзЩ?/span>ODP2дЄ≠дЄЙдЄ?/span>з°ЂиЊЫйЕ∞еМЦдњЃй•∞дљНзВєеЬ®дљУеЖЕзЪДи∞ГжОІжШѓзЫЄеѓєзЛђзЂЛзЪДпЉМеєґдЄФељУдљУеЖЕжДЯеПЧеИ?/span>жХідљУзЪ?/span>з°ЂиЊЫйЕ∞еМЦдњЃй•∞йЩНдљОеИ∞дЄАеЃ?/span>йЩРеЇ¶жЧґпЉМдЉ?/span>еРѓеК®дЄАеЃ?/span>зЪДи°•еБ?/span>и∞ГжОІжЬЇеИґгА?/span>дљЬиА?/span>ињЫдЄАж≠•еЬ®е§ІиВ†жЭЖиПМдЄ?/span>жОҐз©ґдЇЖз°ЂиЊЫйЕ∞еМЦдњЃй•∞дїОе§іеРИжИРйАФеЊДеТМз°ЂиЊЫйЕ∞еМЦдњЃй•∞зЫіжО•еРИжИРйАФеЊДеЬ®з°ЂиЊЫйЕ∞еМЦдњЃй•∞еРИжИРињЗз®ЛзЪДйЗНи¶БжАІгА?/span>йАЪињЗеѓ?/span>дЄЙдЄ™з°ЂиЊЫйЕ∞еМЦдњЃй•∞еРИжИРйЕґињЫи°МжХ≤йЩ?/span>пЉМдљЬиАЕеПСзО?/span>дїОе§іеРИжИРйАФеЊДжѓФзЫіжО•еРИжИРйАФеЊДиµ?/span>дЇЖжЫійЗНи¶БзЪДдљЬзФ®гА?/span>
жЬАеРОпЉМдљЬиАЕињЫдЄАж≠?/span>е∞Жиѓ•еЃЪйЗПеМЦе≠¶иЫЛзЩљиі®зїДе≠¶жµБз®ЛињРзФ®еИ∞еУЇдє≥зїЖиГЮдљУз≥їдЄ≠гА?/span>еИ©зФ®жЦ∞еЮЛзЪДзФµз¶їиЊЕеК©дЇ≤еТМж†Зз≠?/span>CY58пЉ?/span>зїУеРИдЇМзФ≤еЯ?/span>еМЦж†ЗиЃ?/span>еЃЪйЗПз≠ЦзХ•пЉ?/span>дљЬиА?/span>жИРеКЯеЬ?/span>еЃЮзО∞дЇ?/span>еѓ?/span>дЇЇжЇРзїЖиГЮдЄ≠жЙАжЬЙеЈ≤зЯ?/span>зЪ?/span>еЕ≠дЄ™з°ЂиЊЫйЕ∞еМЦдњЃй•∞дљНзВєињЫи°МеЃЪйЗПпЉМжЬЙжЬЫеѓєдЄНеРМз±їеЮЛзФЯзЙ©ж†ЈжЬђдЄ≠зЪДз°ЂиЊЫйЕ∞еМЦдњЃй•∞ж∞іеє≥ињЫи°МжµЛеЃЪгА?/span>
иѓ•жЦЗзЪДйАЪиЃѓдљЬиАЕдЄЇеМЧдЇђе§Іе≠¶еМЦе≠¶дЄОеИЖе≠РеЈ•з®Ле≠¶йЩҐгА?/span>еМЧе§І-жЄЕеНОзФЯеСљиБФеРИдЄ≠ењГзЪДзОЛеИЭжХЩжОИгАВеЕґжМЗеѓЉзЪ?/span>еМЦе≠¶дЄОеИЖе≠РеЈ•з®Ле≠¶йЩ?/span>2016зЇІеНЪе£Ђз†Фз©ґзФЯиµЦдє¶зХЕеТМеНЪе£ЂеРОйЩИйҐЦеНЪе£ЂдЄЇиѓ•жЦЗзЪДеЕ±еРМзђђдЄАдљЬиАЕгАВзОЛеИЭиѓЊйҐШзїДжЭ®еЄЖеНЪе£ЂпЉМиВЦдЉЯеЉЯеНЪе£ЂеТМеИШжЇ?/span>еНЪе£Ђз≠ЙеРИдљЬиАЕдЄЇиѓ•иѓЊйҐ?/span>еБЪеЗЇдЇ?/span>йЗНи¶БзЪДиі°зМЃгА?/span>иѓ•еЈ•дљЬеЊЧеИ∞дЇЖеЯЇйЗСеІФгАБеМЧдЇђеИЖе≠РзІСе≠¶еЫљеЃґз†Фз©ґдЄ≠ењГгАБжХЩиВ≤йГ®зФЯзЙ©жЬЙжЬЇеТМеИЖе≠РеЈ•з®ЛйЗНзВєеЃЮй™МеЃ§гАБеМЧе§?/span>-жЄЕеНОзФЯеСљиБФеРИдЄ≠ењГзЪДзїПиієжФѓжМБгА?/span>
жЦЗзЂ†йУЊжО•пЉ?/span>//pubs.acs.org/doi/10.1021/jacs.2c01528